Введение
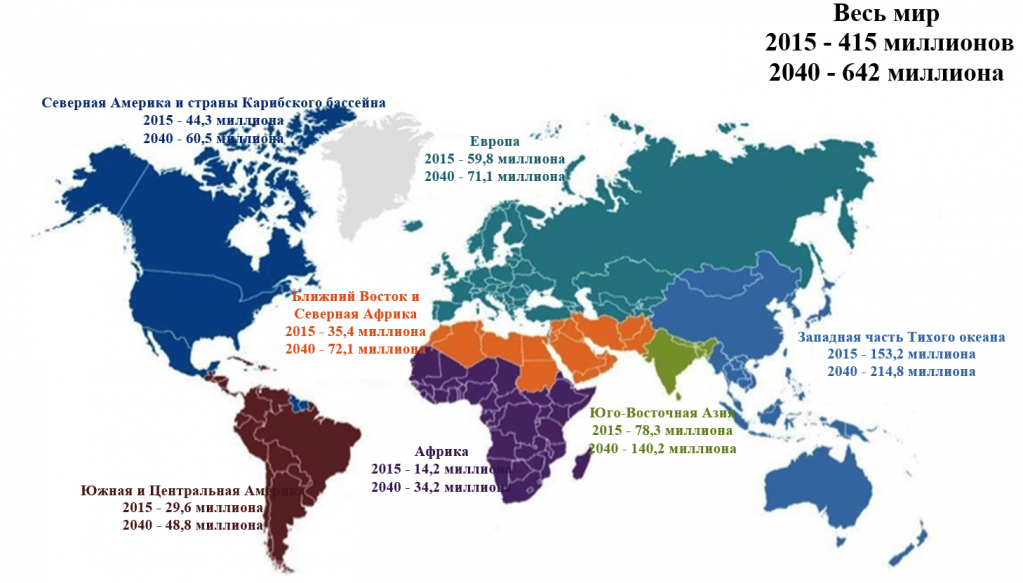
Сахарный диабет (СД) является важной проблемой общественного здравоохранения. Почти 415 миллионов человек во всем мире или каждый одиннадцатый взрослый страдают СД. Примерно 75% проживают в странах с низким или средним уровнем дохода. Если современные тенденции распространенности диабета сохранятся, то к 2040 году примерно 642 миллиона человек или каждый десятый взрослый будут страдать диабетом (Рисунок 1) [1]. Его встречаемость варьирует и с возрастом увеличивается; так в США 9,6% популяции лиц старше 20 лет имеют подтвержденный диабет [2]. Данные, касающиеся жителей Европы, показывают, что распространенность СД и нарушения толерантности к глюкозе у пожилых лиц составляет 10–20% и 30–35% соответственно [3]. Результаты Фрамингемского исследования сердца демонстрируют, что частота его возникновения за последние 30 лет удвоилась [4], а в предстоящие десятилетия ожидается увеличение его распространенности во всем мире [5]. По сравнению с лицами без СД, у пациентов с СД встречаемость атеросклеротического поражения сердца выше. Уровни смертности у пациентов с СД и без инфаркта миокарда (ИМ) в анамнезе и у лиц без СД, но с ИМ в анамнезе, схожи6–8. Степень и тяжесть атеросклеротического поражения сердца также более выражены у пациентов с СД, чем у лиц без него [9–11].
Патофизиология
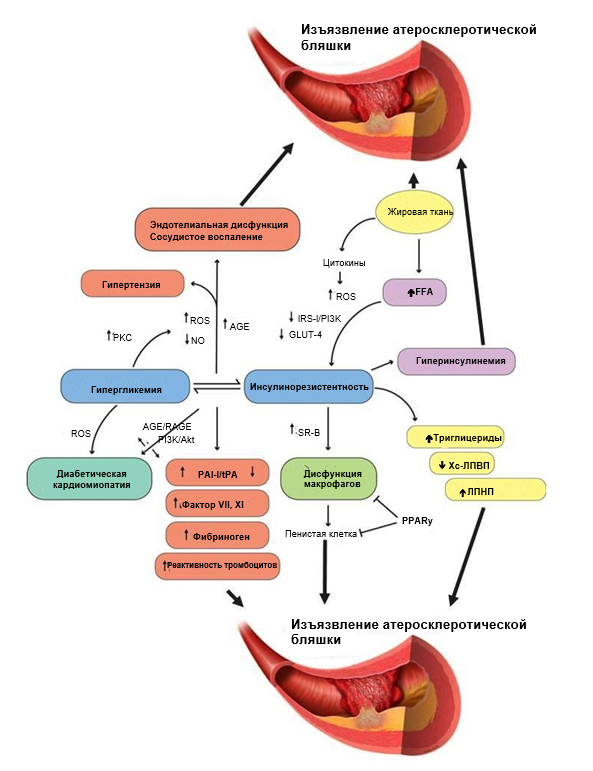
Предложены различные механизмы атерогенеза, связанного с СД (Рисунок 2). Эти механизмы в значительной степени задействуют сигнальные факторы, влияющие на эндотелиальные клетки, гладкомышечные клетки и макрофаги [12–14]. Гипергликемия сама по себе также непосредственно повышает риск возникновения атеросклеротического поражения сердца, нарушая сосудодвигательную функцию [12-14], увеличивает степень гликирования конечных продуктов [15], нежелательное воздействие циркулирующих в крови свободных жирных кислот [16], активирует системное воспаление [17] и усиливает активность тромбоцитов [18,19]. Эти факторы могут влиять как на микрососудистую циркуляцию, так и на эпикардиальные коронарные артерии [20]. Кроме того, другие связанные с диабетом нарушения, такие как нейропатии, поражение почек и диабетическая кардиомиопатия, приводят к плохим клиническим исходам [21–23]. Более подробное обсуждение этих факторов выходит за рамки данного обзора. Тем не менее, существуют многочисленные биологические механизмы, повышающие риск развития атеросклеротического поражения сердца и приводящие к плохим исходам у пациентов с СД.
Стратегии реваскуляризации в современную эру ЧКВ
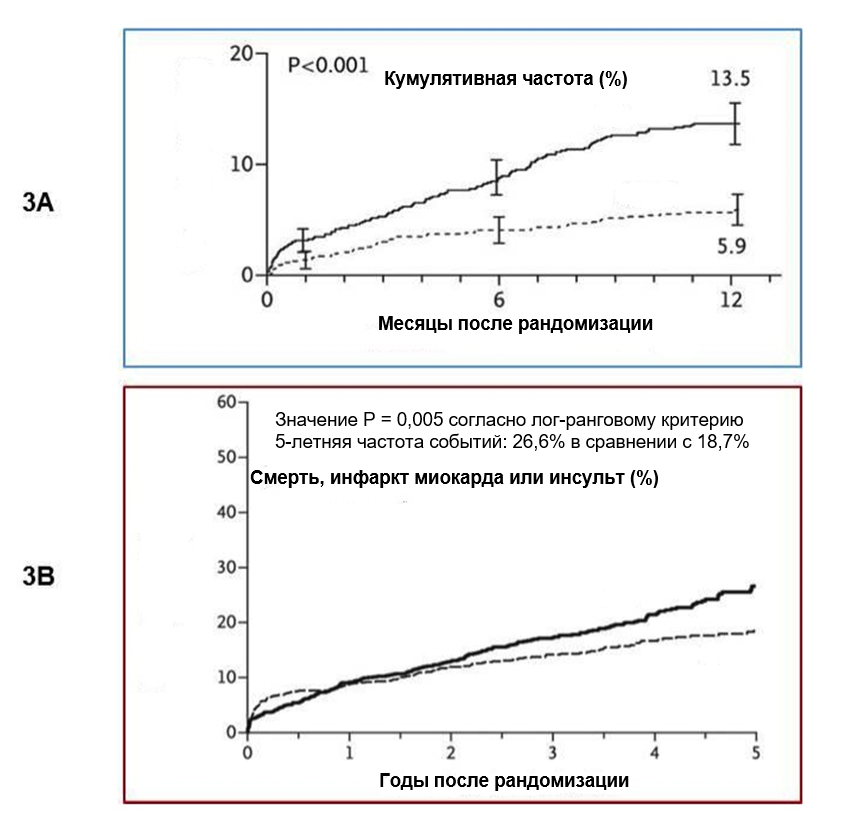
Хорошо известно, что пациенты с СД, перенесшие чрескожное коронарное вмешательство (ЧКВ) и стентирование, подвержены большему риску рестеноза в стенте [24–26] и возникновению нежелательных сердечно-сосудистых явлений [27,28], даже в эру стентов с лекарственным покрытием. Этиология этого, вероятно, многофакторна и включает в себя причины, связанные с самим пациентом (диффузное поражение коронарных артерий и поражение коронарных артерий небольшого диаметра, прогрессирование заболевания [29], эндотелиальная дисфункция и провоспалительное или протромботическое состояние) [30,31], а также со стентом (толщина каркаса стента, резистентность к лекарственному средству и реакция гиперчувствительности на полимер) [32–34]. Таким образом, предпочтительным вариантом реваскуляризации у пациентов с СД остается аортокоронарное шунтирование (АКШ) еще и потому, что оно способно в большей степени защитить сегменты артерий, расположенные проксимальнее шунтов, от прогрессирующего течения ИБС. Действительно, ранее в рандомизированных исследованиях было показано, что у пациентов с СД и многососудистым поражением коронарных артерий, перенесших АКШ, либо летальность, либо частота основных неблагоприятных сердечно-сосудистых явлений ниже, чем у пациентов, подвергшихся ЧКВ [35–38]. Исследования FREEDOM и SYNTAX (Рисунок 3) продемонстрировали, что у пациентов с СД и многососудистым поражением наблюдается преимущество в пользу АКШ в сравнении с ЧКВ в отношении смертности с использованием стентов с лекарственным покрытием 1-го поколения [36,38]. В подгруппе из 452 пациентов с диабетом и ИБС с многососудистым поражением, которые были включены в исследование SYNTAX, у лиц с небольшим значением индекса SYNTAX (≤ 22) частота MACE была схожа для АКШ и ЧКВ (33,7% в сравнении с 42,5% соответственно; p=0,38), но частота повторной реваскуляризации оставалась выше в группе ЧКВ (18,5% в сравнении с 38,5% соответственно; p=0,01). Интересно отметить, что в исследовании SYNTAX диабет не был независимым предиктором исходов при внесении индекса SYNTAX в многофакторную модель [39]. Таким образом, новый индекс SYNTAX II, призванный оптимизировать принятие решений при выборе между АКШ и ЧКВ, сочетает в себе анатомически обоснованное значение индекса SYNTAX и клинические переменные (ИБС с незащищенным стволом левой коронарной артерии, женский пол, хроническую обструктивную болезнь легких, возраст и фракцию выброса левого желудочка), исключая при этом СД. Этот факт четко отмечен в литературных источниках. В самых последних американских и европейский руководствах для пациентов с СД и многососудистым поражением дана настоятельная рекомендация в пользу АКШ, а не ЧКВ; однако, ЧКВ может рассматриваться как альтернативный вариант лечения у больных с диабетом и многососудистым поражением с низким значением индекса SYNTAX (≤ 22) [40,41]. В настоящее время нет ни одного завершенного рандомизированного исследования с участием пациентов с СД и многососудистым поражением, в котором сравнивались бы АКШ и ЧКВ с использованием стентов с лекарственным покрытием 2-го поколения. Исследование BEST было рандомизированным исследованием не меньшей эффективности, проводившимся в 27 центрах Восточной Азии, по сравнению ЧКВ с использованием стентов второго поколения с покрытием эверолимусом и АКШ при многососудистом поражении коронарных артерий [42]. Исследование было прекращено досрочно из-за медленного набора пациентов, причем была набрана лишь половина от числа пациентов, которых предполагалось исходно включить в исследование. При медиане долгосрочного периода последующего наблюдения, равной 4,6 года, первичная комплексная конечная точка (смерть, ИМ или реваскуляризация целевого сосуда) реже достигалась в группе АКШ, чем в группе ЧКВ (10,6% в сравнении с 15,3%, p=0,04). Этот результат был преимущественно обусловлен более высокой частотой реваскуляризации целевого сосуда в группе ЧКВ по сравнению с группой АКШ. Более поздние ретроспективные наблюдательные анализы ЧКВ с использованием стентов с лекарственным покрытием второго поколения у пациентов с многососудистым поражением подтверждают улучшение, касающееся частоты возникновения событий, которое достигнуто благодаря развитию технологии стентов [43] без значимых различий по летальности между АКШ и ЧКВ или даже с тенденцией в пользу ЧКВ [44,45].
Бесполимерный стент, выделяющий амфилимус
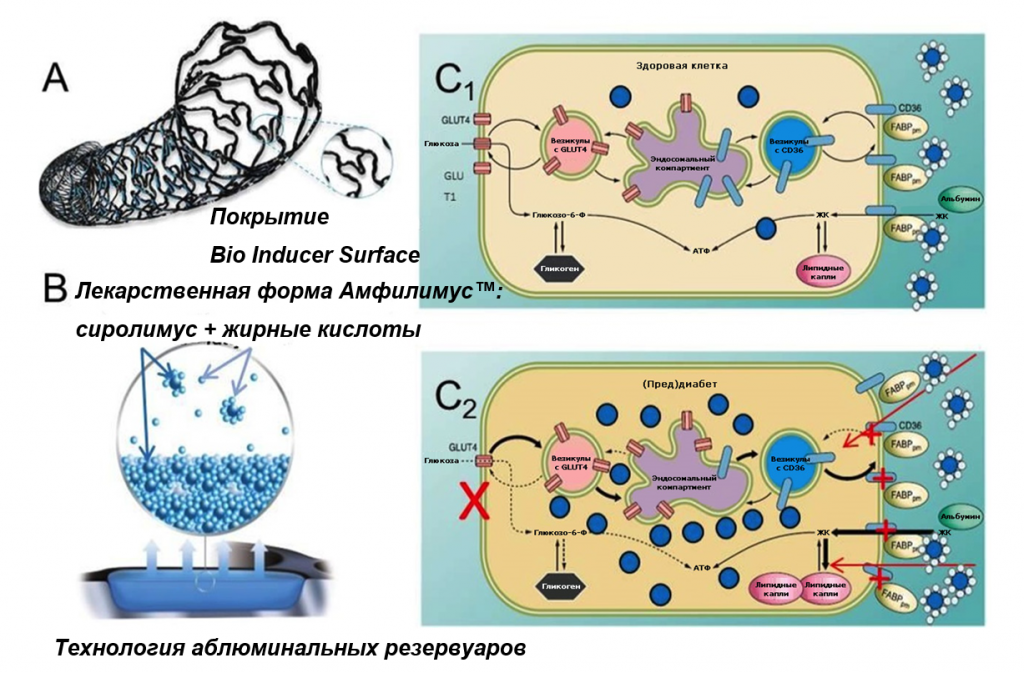
Стент Cre8 (производства компании «CID», Италия, член группы компаний Alvimedica, Турция) представляет собой коронарный стент с лекарственным покрытием 3-го поколения с тонким (70-80 мкм) и гибким кобальт хромовым каркасом. Стент Cre8 обладает 3 отличительными особенностями, затрагивающими важнейшие клинические аспекты, характерные для пациентов с СД: 1) балки стента полностью покрыты ультратонкой (<0,3 пм) инертной пироуглеродной пленкой (коммерческое название – Bio Inducer Surface [BIS]), которая характеризуется улучшенной гемосовместимостью, объясняющейся селективным всасыванием альбумина, который минимально активирует тромбоциты и способствует ускоренной эндотелизации балок стента после имплантации; 2) стент лишен полимера и препарат высвобождается из лунок, вырезанных лазером (называемых резервуарами) на аблюминальной (стороне, противоположной просвету сосуда) поверхности стента. И, хотя нагрузка сиролимусом в стенте Cre8 меньше, чем в стенте Cypher (90 и 140 пг/см2 соответственно), технология с созданием резервуаров позволяет препарату элюировать полностью в стенку сосуда с минимальным его высвобождением в сторону просвета сосуда или вымыванием препарата в кровь (1,74±0,4 нг/мл – Cre8 в сравнении с 12,8±2,3 нг/мл – Cypher); 3) антипролиферативным средством (АмфилимусTM) является сиролимус в смеси с бесполимерным амфифильным носителем, что позволяет контролировать его элюирование, избегая быстрого высвобождения вследствие отсутствия полимера. Носитель состоит из смеси длинноцепочечных жирных кислот, широко распространенных в организме, и поэтому способен участвовать в естественном метаболизме и гомогенно диффундировать в стенку сосуда. Пиковая концентрация препарата в ткани достигается в течение первых дней, причем 50% препарата элюирует примерно за 18 дней, 65-70% препарата высвобождается за 30 дней, а оставшееся количество – за 90 дней [46,47].
Клинические доказательства
Вопросы об оптимальном для пациентов с СД стенте с лекарственным покрытием остаются нерешенными. Стенты 2-го поколения превзошли DES 1-го поколения, особенно в вопросах безопасности [48]. Так, для кобальт хромового стента с покрытием эверолимусом (CoCr-EES) и износостойким полимером были получены надежные доказательства, демонстрирующие у пациентов с СД снижение частоты событий по сравнению с DES 1-го поколения. Также было показано, что стенты DES с биоразлагаемым полимером безопаснее стентов DES 1-го поколения [49]. Но даже при этом, частота тромбоза стентов по прежнему не приемлема, а частота рестенозов в первый год у этих пациентов все еще чрезмерна. Что касается антипролиферативных средств, то иммунодепрессанты макролиды, действующие путем ингибирования m-TOR (например, сиролимус или эверолимус), в клинических условиях зарекомендовали себя как наиболее безопасные и эффективные препараты для управления пролиферацией неоинтимы, которая всегда наступает после коронарного стентирования [47], но значительное количество данных указывает на то, что эта эффективность ослабляется в сосудистых клетках человека, резистентных к инсулину [50]. Важно отметить, что это ослабление можно преодолеть, повысив концентрацию препарата в тканях [33]. В условиях in vitro для достижения уровня супрессии гладкомышечных клеток у больных диабетом доноров, схожего с таковым у здоровых лиц, концентрация сиролимуса должна быть выше более чем в 10 раз [33]. В исследовании 3D даже удвоение дозы сиролимуса в покрытом стенте (SES, 280 мкг/см2) не дало положительного эффекта на гиперплазию неоинтимы в сравнении с контрольной группой, получавших стандартную дозу (140 мкг/см2) [51]. Мы можем предположить, что несмотря на удвоение дозы в стенте, проникновение сиролимуса в клетки, пораженные диабетом, оставалось недостаточным. Однако, механизм этой потери эффективности до конца не понятен, хотя он заставляет нас вернуться к разработке стентов с лекарственным покрытием, специально предназначенных для пациентов с СД, и может иметь важное значение в понимании многообещающих результатов применения стента Cre8 в этой популяции. Многоцентровое рандомизированное исследование сравнения стентов, покрытых амфилимусом и паклитакселом, при de novo поражениях нативных коронарных артерий (NEXT)52 было первым шагом в поддержку гипотезы о том, что стент Cre8 мог бы быть этим желанным стентом. В исследовании через 6 месяцев после процедуры проводили количественный анализ коронарной ангиографии: поздняя потеря просвета в стенте (LLL, первичная конечная точка) была значимо меньше у стента Cre8, чем у покрытых паклитакселом стентов (Taxus Liberté, Boston Scientific, Natick, Massachusetts) – 0,14±0,36 мм в сравнении с 0,34±0,40 мм, достигая при этом статистической значимости как в отношении не меньшей эффективности (p<0,0001), так и превосходства (p<0,0001). Схожие результаты были представлены и в анализе post-hoc у пациентов с СД, где, помимо этого, следует отметить, что LLL в группе СД составила 0,12±0,28 мм, что было сопоставимо с данными, полученными в популяции всех пришедших пациентов, и было также значимо меньше, чем для стента Taxus Liberté (0,43±0,41 мм, p<0,0001).
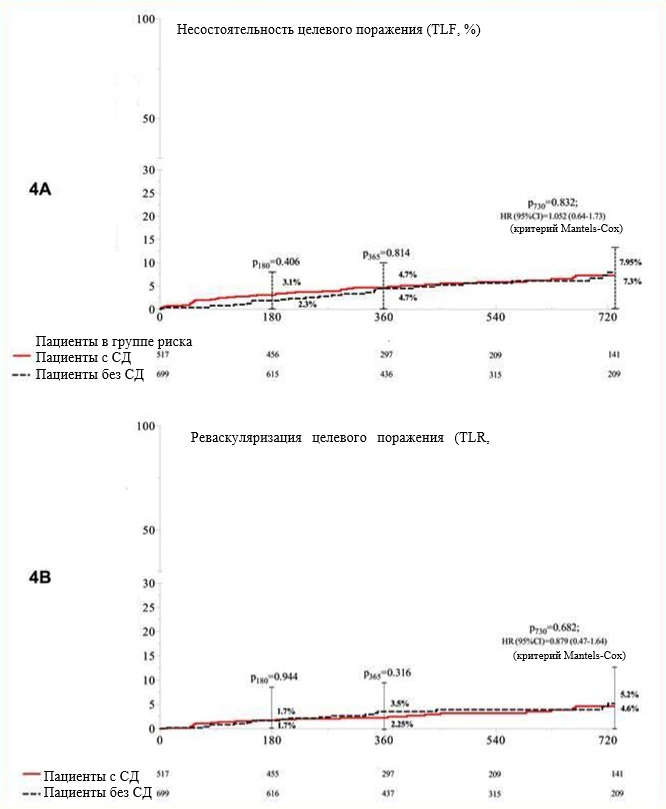
Исследованием RESERVOIR 53 (рандомизированное сравнение бесполимерных резервуарных стентов, покрытых амфилимусом, и покрытых эверолимусом стентов с недеградируемым полимером у пациентов с сахарным диабетом) было вторым шагом и первым рандомизированным многоцентровым исследованием не меньшей эффективности, специально разработанным для оценки стента Cre8 у пациентов с СД по сравнению со стентом CoCr-EES (Xience, "Эбботт Васкулар", Калифорния, США).44-54 С помощью оптической когерентной томографии через 9 месяцев оценивали первичную конечную точку (объем неоинтимальной обструкции [NVO]), которая была ниже в группе Cre8 (11,97±5,94% в сравнении с 16,11±18,18%, для не меньшей эффективности p = 0,0003; для превосходства p = 0,22). Заранее определенный анализ по подгруппам показал, что превосходство стента Cre8 было тенденцией, отмечавшейся во всех подгруппах пациентов с более плохим метаболическим контролем: потребность в инсулинотерапии, низкий уровень ЛПВП, высокий уровень ЛПНП и, что самое главное, в подгруппе пациентов с более высоким уровнем HbA1c, стент Cre8 демонстрировал даже статистически значимое превосходство (различие по NVO, 10,62, 95%-ный ДИ -22,58-1,69; p=0,02). Что касается безопасности стентов, то в обеих группах пациентов доля непокрытых балок стента была схожа. Также стент Cre8 продемонстрировал не меньшую эффективность в отношении минимального диаметра просвета и диаметра стеноза. Кроме того, значение LLL в группе Cre8 составило 0,14±0,24 мм, а в группе стента Xience – 0,24±0,57 мм. И наконец, в двух группах были получены схожие результаты по клиническим событиям через 12 месяцев. После того, как были получены эти обнадеживающие результаты, в условиях реальной клинической практики были созданы три регистра: INVESTIG8, PARTICIP8 и ASTUTE. В исследованиях INVESTIG8 и ASTUTE первичной комплексной конечной точкой (сердечная смерть/ИМ в целевом сосуде/реваскуляризация целевого сосуда [TLR]) была несостоятельность целевого поражения (TLF). Вторичными конечными точками были TLR, частота возникновения значительных нежелательных сердечно-сосудистых явлений (MACE) (все летальные случаи/все случаи ИМ/любая реваскуляризация) и частота тромбозов стента по определению классификации Академического исследовательского консорциума. Однолетние результаты исследования INVESTIG8 были представлены на конференции EuroPCR 2015 и показали, что однолетняя TLF отмечалась у 3,5% пациентов без диабета и у 5% лиц с СД. Отсутствие событий было зарегистрировано у 97,8% лиц без диабета из исследуемой популяции и у 95,6% пациентов с СД. Определенный и вероятный тромбозы стентов наблюдались лишь у 0,6% лиц без диабета и у 1,4% пациентов с диабетом. В регистре ASTUTE содержатся данные как одно-, так и двухлетнего последующего наблюдения после указанной процедуры55. Этот регистр показал, что: 1) стентирование с использованием Cre8 у всех пациентов было сопряжено с низкой однолетней частотой возникновения нежелательных явлений без значимых различий в отношении TLF, TLR и других значительных нежелательных явлений между пациентами с СД и без него; 2) первичная, а также и вторичные конечные точки были схожи среди инсулинозависимых и инсулиннезависимых пациентов с СД; 3) схожие результаты сохранялись до 2 лет последующего наблюдения (Рисунок 4). В клиническом наблюдательном проспективном исследовании PARTICIP8 100 пациентов из заранее определенной подгруппы больных диабетом были направлены на прохождения контрольного ангиографического исследования. Клинические данные были представлены на ежегодной Конференции ТСТ в 2015 году и содержали сведения за шесть месяцев и один год: в популяции больных диабетом частота MACE составила 3,4% и 4,7%, тогда как частота возникновения TLR была равна 0,78% и 1,4% через 6 месяцев и 1 год соответственно. Однолетний показатель LLL в группе пациентов с диабетом равнялся 0,16±0,13 мм, это значение было близко к результатам, полученным в исследованиях NEXT и RESERVOIR. Последние данные были получены из недавней пока еще неопубликованной работы нашей группы, в которой клинические исходы стента Cre8 и стента с биоразлагаемым полимером (BP, Nobori, «Терумо», Япония) ретроспективно сравнивали у пациентов с СД и без него до и после сопоставления по индексу соответствия. Данные были взяты из двух многоцентровых итальянских регистров – ASTUTE56 и INSPIRE-1.57 В популяции, согласованной по СД, мы установили, что стент Cre8 продемонстрировал значимо более низкие однолетние частоты TLF (12 из 240 [5%] в сравнении с 31 из 240 [13%]; Plog-rank=0,002) и TLR (9 из 240 [4%] в сравнении с 21 из 240 [9%]; Plog-rank=0,019) по сравнению со стентом BD-BES, применение которого было наиболее сильным предиктором TLF. Наоборот, у пациентов, несогласованных по СД, конечные точки как в отношении безопасности, так и эффективности, были схожи между двумя группами стентированных пациентов, а наиболее сильным предиктором TLF была хроническая болезнь почек. Несогласованный популяционный анализ продемонстрировал результаты, схожие с этими данными.
Особенности стента Cre8 и патофизиологические механизмы у больных диабетом
Все эти исследования внесли свой вклад в постоянно накапливающиеся клинические данные, подтверждающие эффективность и безопасность применения стента Cre8 у пациентов с диабетом. Объяснением этому могут служить особенности данного стента, позволяющие уменьшить влияние патофизиологических механизмов, подвергающих этих пациентов более высокому риску возникновения рестеноза в стенте [24–26] и нежелательных сердечно-сосудистых явлений, даже в условиях лечения стентами с лекарственным покрытием последнего поколения [27-28-58]. Хотя полимер представляет собой резервуар для программируемого высвобождения лекарственного препарата, его функционирование прекращается после того, как препарат заканчивается, и он может негативно влиять на безопасность и эффективность самого устройства. Действительно, с износостойкими полимерами могут быть связаны с воспаления, неоатеросклероз и неполная эндотелизация стента, что может вносить свой вклад в риск развития нежелательных явлений [59 60 61] и также наблюдаются при использовании новых стентов с лекарственным покрытием с недеградируемыми полимерами [62-63]. Мы можем предположить, что в провоспалительной среде, характерной для пациентов с СД30-31, отсутствие полимера и тонкие балки стента могли бы играть ключевую роль. Лекарственная форма АмфилимусTM может быть даже более важна благодаря сочетанию сиролимуса и смеси длинноцепочечных жирных кислот, широко распространенных в организме в нормальных условиях, и, поэтому, способных участвовать в естественном процессе метаболизма посредством мембранных транспортеров жирных кислот (CD36) и других белков, связывающихся с жирными кислотами (FABP). У пациентов с СД, из-за их патологической резистентности к инсулину, сердце для образования АТФ вынуждено использовать исключительно жирные кислоты. Действительно, у пациентов с СД белки-транспортеры жирных кислот сосудистых клеток экспрессируются в избыточном количестве [64]. Поэтому можно предположить, что использование жирных кислот в качестве носителя может способствовать проникновению сиролимуса в клетки с повышенным захватом жирным кислот, например, в инсулин-резистентные клетки [65]. В то же самое время известно, что гладкомышечные клетки сосудов сердца больных диабетом проявляют относительную устойчивость к ингибированию пролиферации под действием рапамицина, и это препятствие можно преодолеть, повысив внутриклеточную концентрацию препарата [33]. Таким образом, повышение уровня транспортеров жирных кислот предположительно увеличит доставку сиролимуса в резистентные клетки, пораженные диабетом, и это уменьшит пролиферацию неоинтимы, объясняя эффективность устройства (Рисунок 5). В то же самое время этот повышенный захват антипролиферативного средства не отсрочит исцеление сосуда и не приведет к неполной эндотелизации стента. Действительно, при оценке с помощью оптической когерентной томографии (ОКТ) результаты стентирования с помощью стента Cre8 через 3 месяца были сопоставимы по покрытию балок стента с результатами стентирования с помощью стента Vision/Multilink8 через 1 месяц (исследование DEMONST8) [66] и равны по числу непокрытых балок стента с результатами стентирования с помощью стента CoCr-EES, полученными в исследовании RESERVOIR с помощью ОКТ через 9 месяцев последующего наблюдения [67]. Это показывает эффективность технологии аблюминальных резервуаров для высвобождения лекарственного препарата и биоинертного покрытия Bio Inducer Surface. Вместе они усиливают прикрепление эндотелиальных клеток-предшественников из периферического кровотока и облегчают прорастание эндотелиальной тканью дистального и проксимального краев стента, приводя к ускоренной эндотелизации после имплантации PF-AES [68 52].
Заключение
Сахарный диабет – распространенное заболевание, увеличивающее риск возникновения атеросклеротического поражения сердца и смертность, в ближайшем будущем оно останется крупной проблемой для нашей системы здравоохранения. У пациентов с СД и многососудистым поражением с умеренно выраженным или высоким значением индекса SYNTAX АКШ является предпочтительным методом реваскуляризации, особенно при стабильном течении ишемической болезни сердца. Для пациентов с СД и менее сложным многососудистым поражением (т.е. низкое значение индекса SYNTAX) или острым коронарным синдромом обосновано проведение либо ЧКВ (предпочтительно с использованием стентов с лекарственным покрытием 2-го и 3-го поколений), либо АКШ. Стент Cre8 – бесполимерный покрытый амфилимусом стент – продемонстрировал у пациентов с СД обнадеживающие предварительные результаты. Проспективные исследования, проводившиеся при спонсорской поддержке или независимо, а также специальный согласованный анализ придали новый толчок для поиска стентов с целью достижения лучших исходов у пациентов с СД. Тем не менее, это лишь предварительные результаты, и для окончательного подтверждения не меньшей эффективности и возможного превосходства стента Cre8 над современными стентами в этой популяции пациентов высокого риска необходимо проведение рандомизированного клинического исследования, обладающего достаточной мощностью. Дальнейшие совершенствования свойств стентов в сочетании с интенсивной лекарственной терапией могут значительно изменить масштабы и направления будущих научных исследований и клинической практики.
ССЫЛКИ
- © International Diabetes Federation 2015. IDF DIABETES ATLAS Seventh Edition. 2015; : ISBN: 978-2-930229-81-2.
- Bethesda, MD: US Department of Health and Human Services NI of H. National Diabetes Statistics fact sheet: general information and national estimates on diabetes in the United States, 2005. 2005.
- DECODE Study Group. Age- and sex-specific prevalences of diabetes and impaired glucose regulation in 13 European cohorts. Diabetes Care. 2003; 26: 61–9.
- Fox CS, Pencina MJ, Meigs JB, Vasan RS, Levitzky YS, D’Agostino RB. Trends in the Incidence of Type 2 Diabetes Mellitus From the 1970s to the 1990s: The Framingham Heart Study. Circulation 2006; 113: 2914–8.
- Wild S, Roglic G, Green A, Sicree R, King H. Global prevalence of diabetes: estimates for the year 2000 and projections for 2030. Diabetes Care 2004; 27: 1047–53.
- Haffner SM, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Mortality from Coronary Heart Disease in Subjects with Type 2 Diabetes and in Nondiabetic Subjects with and without Prior Myocardial Infarction. N Engl J Med 1998; 339: 229–34.
- Malmberg K, Yusuf S, Gerstein HC, et al. Impact of diabetes on long-term prognosis in patients with unstable angina and non-Q-wave myocardial infarction: results of the OASIS (Organization to Assess Strategies for Ischemic Syndromes) Registry. Circulation 2000; 102: 1014–9.
- Yusuf S, Sleight P, Pogue J, Bosch J, Davies R, Dagenais G. Effects of an Angiotensin-Converting– Enzyme Inhibitor, Ramipril, on Cardiovascular Events in High-Risk Patients. N Engl J Med 2000; 342: 145–53.
- Waller BF, Palumbo PJ, Lie JT, Roberts WC. Status of the coronary arteries at necropsy in diabetes mellitus with onset after age 30 years. Analysis of 229 diabetic patients with and without clinical evidence of coronary heart disease and comparison to 183 control subjects. Am J Med 1980; 69: 498– 506.
- Pajunen P, Taskinen MR, Nieminen MS, Syvanne M. Angiographic severity and extent of coronary artery disease in patients with type 1 diabetes mellitus. Am J Cardiol 2000; 86: 1080–5.
- Natali A, Vichi S, Landi P, Severi S, L’Abbate A, Ferrannini E. Coronary atherosclerosis in Type II diabetes: angiographic findings and clinical outcome. Diabetologia 2000; 43: 632–41.
- Piga R, Naito Y, Kokura S, Handa O, Yoshikawa T. Short-term high glucose exposure induces monocyte-endothelial cells adhesion and transmigration by increasing VCAM-1 and MCP-1 expression in human aortic endothelial cells. Atherosclerosis 2007; 193: 328–34.
- Otsuka A, Azuma K, Iesaki T, et al. Temporary hyperglycaemia provokes monocyte adhesion to endothelial cells in rat thoracic aorta. Diabetologia 2005; 48: 2667–74.
- QUAGLIARO L, PICONI L, ASSALONI R, et al. Intermittent high glucose enhances ICAM-1, VCAM-1 and E-selectin expression in human umbilical vein endothelial cells in culture: The distinct role of protein kinase C and mitochondrial superoxide production. Atherosclerosis 2005; 183: 259–67.
- Kilhovd BK, Berg TJ, Birkeland KI, Thorsby P, Hanssen KF. Serum levels of advanced glycation end products are increased in patients with type 2 diabetes and coronary heart disease. Diabetes Care 1999; 22: 1543–8.
- Guzzardi MA, Hodson L, Guiducci L, et al. Independent effects of circulating glucose, insulin and NEFA on cardiac triacylglycerol accumulation and myocardial insulin resistance in a swine model. Diabetologia 2014; 57: 1937–46.
- Shoelson SE, Lee J, Yuan M. Inflammation and the IKKβ/IκB/NF-κB axis in obesity- and diet- induced insulin resistance. Int J Obes 2003; 27: S49–52.
- Shah B, Sha D, Xie D, Mohler ER, Berger JS. The Relationship Between Diabetes, Metabolic Syndrome, and Platelet Activity as Measured by Mean Platelet Volume: The National Health and Nutrition Examination Survey, 1999-2004. Diabetes Care 2012; 35: 1074–8.
- Vinik AI, Erbas T, Park TS, Nolan R, Pittenger GL. Platelet dysfunction in type 2 diabetes. Diabetes Care 2001; 24: 1476–85.
- Cortigiani L, Rigo F, Gherardi S, Galderisi M, Bovenzi F, Sicari R. Prognostic Meaning of Coronary Microvascular Disease in Type 2 Diabetes Mellitus: A Transthoracic Doppler Echocardiographic Study. J Am Soc Echocardiogr 2014; 27: 742–8.
- Kiviniemi AM, Hautala AJ, Karjalainen JJ, et al. Impact of type 2 diabetes on cardiac autonomic responses to sympathetic stimuli in patients with coronary artery disease. Aut Neurosci 2013; 179: 142–7.
- Su X, Han X, Mancuso DJ, Abendschein DR, Gross RW. Accumulation of Long-Chain Acylcarnitine and 3-Hydroxy Acylcarnitine Molecular Species in Diabetic Myocardium: Identification of Alterations in Mitochondrial Fatty Acid Processing in Diabetic Myocardium by Shotgun Lipidomics †. Biochemistry 2005; 44: 5234–45.
- Harris IS, Treskov I, Rowley MW, et al. G-protein signaling participates in the development of diabetic cardiomyopathy. Diabetes 2004; 53: 3082–90.
- Kereiakes DJ, Cutlip DE, Applegate RJ, et al. Outcomes in Diabetic and Nondiabetic Patients Treated With Everolimus- or Paclitaxel-Eluting Stents. J Am Coll Cardiol 2010; 56: 2084–9.
- Kufner S, Byrne RA, Dommasch M, Massberg S, Schoemig A, Kastrati A. Comparison of “limus”- eluting stents with permanent-vs biodegradable polymer in patients with diabetes mellitus with coronary artery disease. Eur Heart J 2012; 33: 558–9.
- Stone GW, Kedhi E, Kereiakes DJ, et al. Differential clinical responses to everolimus-eluting and Paclitaxel-eluting coronary stents in patients with and without diabetes mellitus. Circulation 2011; 124: 893–900.
- Cutlip DE, Chhabra AG, Baim DS, et al. Beyond restenosis: five-year clinical outcomes from second- generation coronary stent trials. Circulation 2004; 110: 1226–30.
- Lee TT, Feinberg L, Baim DS, et al. Effect of diabetes mellitus on five-year clinical outcomes after single-vessel coronary stenting (a pooled analysis of coronary stent clinical trials). Am J Cardiol 2006; 98: 718–21.
- Morgan KP, Kapur a, Beatt KJ. Anatomy of coronary disease in diabetic patients: an explanation for poorer outcomes after percutaneous coronary intervention and potential target for intervention. Heart 2004; 90: 732–8.
- Hadi H a R, Suwaidi J Al. Endothelial dysfunction in diabetes mellitus. Vasc Health Risk Manag 2007; 3: 853–76.
- Schalkwijk CG, Stehouwer CD. Vascular complications in diabetes mellitus: the role of endothelial dysfunction. Clin Sci 2005; 109: 143–59.
- Dangas GD, Claessen BE, Caixeta A, Sanidas EA, Mintz GS, Mehran R. In-stent restenosis in the drug-eluting stent era. J. Am. Coll. Cardiol. 2010; 56: 1897–907.
- Lightell DJ, Woods TC. Relative resistance to Mammalian target of rapamycin inhibition in vascular smooth muscle cells of diabetic donors. Ochsner J 2013; 13: 56–60.
- Denardo SJ, Carpinone PL, Vock DM, Batich CD, Pepine CJ. Changes to polymer surface of drug- eluting stents during balloon expansion. JAMA 2012; 307: 2148–50.
- Comparison of Coronary Bypass Surgery with Angioplasty in Patients with Multivessel Disease. N Engl J Med 1996; 335: 217–25.
- Farkouh ME, Domanski M, Sleeper LA, et al. Strategies for multivessel revascularization in patients with diabetes. N Engl J Med 2012; 367: 2375–84.
- Kapur A, Hall RJ, Malik IS, et al. Randomized Comparison of Percutaneous Coronary Intervention With Coronary Artery Bypass Grafting in Diabetic Patients. J Am Coll Cardiol 2010; 55: 432–40.
- Serruys PW, Morice M-C, Kappetein AP, et al. Percutaneous Coronary Intervention versus Coronary- Artery Bypass Grafting for Severe Coronary Artery Disease. N Engl J Med 2009; 360: 961–72.
- Farooq V, van Klaveren D, Steyerberg EW, et al. Anatomical and clinical characteristics to guide decision making between coronary artery bypass surgery and percutaneous coronary intervention for individual patients: development and validation of SYNTAX score II. Lancet (London, England) 2013; 381: 639–50.
- Fihn SD, Gardin JM, Abrams J, et al. 2012 ACCF/AHA/ACP/AATS/PCNA/SCAI/STS guideline for the diagnosis and management of patients with stable ischemic heart disease: a report of the American College of Cardiology Foundation/American Heart Association task force on practice guidelines, and the. Circulation 2012; 126: e354--471.
- Authors/Task Force members, Windecker S, Kolh P, et al. 2014 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J 2014; 35: 2541–619.
- Park S-J, Ahn J-M, Kim Y-H, et al. Trial of Everolimus-Eluting Stents or Bypass Surgery for Coronary Disease. N Engl J Med 2015; 372: 1204–12.
- Bangalore S, Guo Y, Samadashvili Z, Blecker S, Xu J, Hannan EL. Everolimus Eluting Stents Versus Coronary Artery Bypass Graft Surgery for Patients With Diabetes Mellitus and Multivessel Disease. Circ Cardiovasc Interv 2015; 8: e002626.
- Bangalore S, Guo Y, Samadashvili Z, Blecker S, Xu J, Hannan EL. Everolimus-eluting stents or bypass surgery for multivessel coronary disease. N Engl J Med 2015; 372: 1213–22.
- Ben-Gal Y, Mohr R, Feit F, et al. Surgical Versus Percutaneous Coronary Revascularization for Multivessel Disease in Diabetic Patients With Non-ST-Segment-Elevation Acute Coronary Syndrome: Analysis From the Acute Catheterization and Early Intervention Triage Strategy Trial. Circ Cardiovasc Interv 2015; 8: e002032–e002032.
- Romaguera R, Gómez-Lara J, Jacobi F, Gomez-Hospital JA, Cequier A. Polymer-free amphilimus- eluting stents in patients with diabetes mellitus. Minerva Cardioangiol 2014; 62: 421–6.
- Moretti C, Lolli V, Perona G, et al. Cre8TM coronary stent: preclinical in vivo assessment of a new generation polymer-free DES with AmphilimusTM formulation. EuroIntervention 2012; 7: 1087–94.
- Kufner S, Byrne RA, Mehilli J, et al. Second-versus first-generation “Limus”-eluting stents in diabetic patients with coronary artery disease: a randomized comparison in setting of ISAR-TEST-4 trial. Catheter Cardiovasc Interv 2013; 82: E769-76.
- de Waha A, Stefanini GG, King LA, et al. Long-term outcomes of biodegradable polymer versus durable polymer drug-eluting stents in patients with diabetes a pooled analysis of individual patient data from 3 randomized trials. Int J Cardiol 2013; 168: 5162–6.
- Patterson C, Mapera S, Li H-H, et al. Comparative effects of paclitaxel and rapamycin on smooth muscle migration and survival: role of AKT-dependent signaling. Arterioscler Thromb Vasc Biol 2006; 26: 1473–80.
- Hur S-H, Ako J, Shimada Y, et al. Two-year intravascular ultrasound observations in diabetic patients treated with single and double dose sirolimus-eluting stents: results of the double dose diabetes (3D) study. J Invasive Cardiol 2008; 20: 411–6.
- Carrié D, Berland J, Verheye S, et al. A multicenter randomized trial comparing amphilimus- with paclitaxel-eluting stents in de novo native coronary artery lesions. J Am Coll Cardiol 2012; 59: 1371– 6.
- Romaguera R, Gómez-Hospital JA, Gomez-Lara J, et al. A Randomized Comparison of Reservoir- Based Polymer-Free Amphilimus-Eluting Stents Versus Everolimus-Eluting Stents with Durable Polymer in Patients with Diabetes Mellitus the RESERVOIR Clinical Trial. JACC Cardiovasc Interv 2016; 9: 42–50.
- Bangalore S, Toklu B, Feit F. Outcomes with coronary artery bypass graft surgery versus percutaneous coronary intervention for patients with diabetes mellitus: can newer generation drug- eluting stents bridge the gap? Circ Cardiovasc Interv 2014; 7: 518–25.
- Colombo A, Godino C, Donahue M, et al. One-year clinical outcome of amphilimus polymer-free drug-eluting stent in diabetes mellitus patients Insight from the ASTUTE registry ( AmphilimuS iTalian mUlticenTre rEgistry ). Int J Cardiol 2016; 214: 113–20.
- Colombo A, Godino C, Donahue M, et al. One-year clinical outcome of amphilimus polymer-free drug-eluting stent in diabetes mellitus patients Insight from the ASTUTE registry (AmphilimuS Italian mUlticenTre rEgistry). Int J Cardiol 2016; 214: 113–20.
- Godino C, Parenti DZ, Regazzoli D, et al. One-year outcome of biolimus eluting stent with biodegradable polymer in all comers: the Italian Nobori Stent Prospective Registry. Int J Cardiol 2014; 177: 11–6.
- Park KW, Lee JM, Kang S-H, et al. Everolimus-Eluting Xience V/Promus Versus Zotarolimus- Eluting Resolute Stents in Patients With Diabetes Mellitus. JACC Cardiovasc Interv 2014; 7: 471–81.
- Virmani R, Guagliumi G, Farb A, et al. Localized hypersensitivity and late coronary thrombosis secondary to a sirolimus-eluting stent: should we be cautious? Circulation 2004; 109: 701–5.
- Kang S-J, Lee CW, Song H, et al. OCT analysis in patients with very late stent thrombosis. JACC Cardiovasc Imaging 2013; 6: 695–703.
- Joner M, Finn A V, Farb A, et al. Pathology of drug-eluting stents in humans: delayed healing and late thrombotic risk. J Am Coll Cardiol 2006; 48: 193–202.
- Nakazawa G, Nakano M, Otsuka F, et al. Evaluation of Polymer-Based Comparator Drug-Eluting Stents Using a Rabbit Model of Iliac Artery Atherosclerosis. Circ Cardiovasc Interv 2011; 4: 38–46.
- Byrne RA, Joner M, Kastrati A. Polymer coatings and delayed arterial healing following drug-eluting stent implantation. Minerva Cardioangiol 2009; 57: 567–84.
- Glatz JFC, Luiken JJFP, Bonen A. Membrane fatty acid transporters as regulators of lipid metabolism: implications for metabolic disease. Physiol Rev 2010; 90: 367–417.
- Chabowski A, Górski J, Glatz JFC, P Luiken JJF, Bonen A. Protein-mediated Fatty Acid Uptake in the Heart. Curr Cardiol Rev 2008; 4: 12–21.
- Prati F, Romagnoli E, Valgimigli M, et al. Randomized comparison between 3-month Cre8 DES vs. 1-month Vision/Multilink8 BMS neointimal coverage assessed by OCT evaluation: the DEMONSTRATE study. Int J Cardiol 2014; 176: 904–9.
- Romaguera R, Gómez-Hospital JA, Gomez-Lara J, et al. A Randomized Comparison of Reservoir- Based Polymer-Free Amphilimus-Eluting Stents Versus Everolimus-Eluting Stents With Durable Polymer in Patients With Diabetes Mellitus: The RESERVOIR Clinical Trial. JACC Cardiovasc Interv 2016; 9: 42–50.
- Moretti C, Lolli V, Perona G, et al. Cre8TM coronary stent: preclinical in vivo assessment of a new generation polymer-free DES with AmphilimusTM formulation. EuroIntervention 2012; 7: 1087–94.
